CFTR-modulator repareert foutjes in CFTR-eiwit niet, maar omzeilt ze
We zijn weer een stap verder in het begrijpen van het defect in het CFTR-eiwit bij CF en de invloed daarop van CFTR-modulatoren. De groep van prof. Ineke Braakman (UU) heeft hier onderzoek naar kunnen doen, mede dankzij jullie donaties in het najaar van 2021 aan ‘Steunen is een eitje‘. Uitkomsten van het onderzoek wijzen erop dat CFTR-modulatorenMedicijnen die de oorzaak van CF aanpakken. de fout in het eiwit niet repareren, maar omzeilen. Hoe dit onderzocht werd en wat het precies inhoudt, lees je in dit artikel.
Achtergrond
Het CFTR-eiwitHet chloridekanaal waarvan de werking verstoord is bij mensen met CF en dat belangrijk is voor een goede balans tussen water en zout (goed slijm) in ons lichaam. is als een lange parelketting van 1480 bouwstenen (aminozuren), die opgevouwen moet worden tot zijn 3D-vorm om te werken als chloridekanaal. Het vouwproces gaat stap voor stap. Onderzoekers hebben al ontdekt dat de ketting uit vier verschillende stukken (domeinen) bestaat, die dan samen één werkend 3D-eiwit vormen: het chloridekanaalHet CFTR-eiwit dat zorgt voor transport van chloride de cellen uit. Chloride trekt water aan zodat er een goede slijmlaag wordt gevormd.. Hoe dat vouwproces precies verloopt, en hoe CFTR-modulatoren daar van invloed op zijn (zie ook de illustratie verderop), is nu ook onderzocht.
Waarom is dit onderzoek belangrijk?
Dit soort onderzoek is van belang om bijvoorbeeld nieuwe of verbeterde medicijnen te maken. De verschillende medicijnen in de combinatie elexacaftor/tezacaftor/ivacaftor (Kaftrio) werken voor veel mensen met CF. Maar hóe ze precies werken en waarom níet bij bepaalde CF-veroorzakende mutaties, is grotendeels onbekend. Daarnaast weten we nog weinig over hoe CFTR-eiwitten met mutaties eruit zien en wat er gebeurt met de vier domeinen van de parelkettingen. Deze kennis is nodig voor nieuwe medicijnontwikkelingen.
Hoe wordt dit onderzocht?
De onderzoekers knippen eerst het CFTR-eiwit in stukjes. Het knippen van eiwitten is vergelijkbaar met het knippen van wol: een losse draad kan gemakkelijker geknipt worden dan een strak opgerolde bol wol. Zo werkt het ook bij eiwitten: een goed gevouwen eiwit is compact en daardoor goed beschermd tegen knippen. CFTR-eiwit met de F508del-mutatie is niet goed gevouwen en wordt sneller in stukken geknipt dan het gezonde CFTR-eiwit.
Na het knippen halen de onderzoekers specifieke fragmenten van elk domein uit het mengsel van de verschillende stukken CFTR-eiwit. Zo kan voor elk domein aangetoond worden hoe compact het gevouwen was. Hiermee kan nauwkeurig bepaald worden hoe elk domein vouwt, hoe ze samen één gevouwen CFTR-eiwit vormen, en waar en wanneer het vouwproces misgaat in de verschillende CFTR-eiwitten met een mutatie.
De resultaten
Dit onderzoek laat zien dat CFTR in twee fasen vouwt: in fase 1 vouwen drie van de vier CFTR-domeinen apart van elkaar. In fase 2 voegen ze samen waardoor ook het vierde domein vorm krijgt. Maar de F508del-mutatie verhindert al in fase 1 het stabiel vouwen van het domein waar de mutatie in zit. Het gevolg is dat ook fase 2 niet plaatsvindt. Door behandeling met elexacaftor/tezacaftor/ivacaftor (Kaftrio) worden de vier domeinen alsnog samengevoegd en vindt fase 2 plaats. Het eiwit functioneert dan (deels) weer, ondanks dat een van de domeinen van de samengevoegde 3D-vorm nog steeds defect is.
Samenvoegen van de vier domeinen (b)lijkt dus belangrijker dan dat de individuele domeinen gerepareerd worden. Dat elexacaftor/tezacaftor/ivacaftor (Kaftrio) de vier domeinen altijd samenvoegt en niet individueel repareert, verklaart waarom zoveel verschillende mutaties met zoveel verschillende defecten toch allemaal goed reageren op Kaftrio.
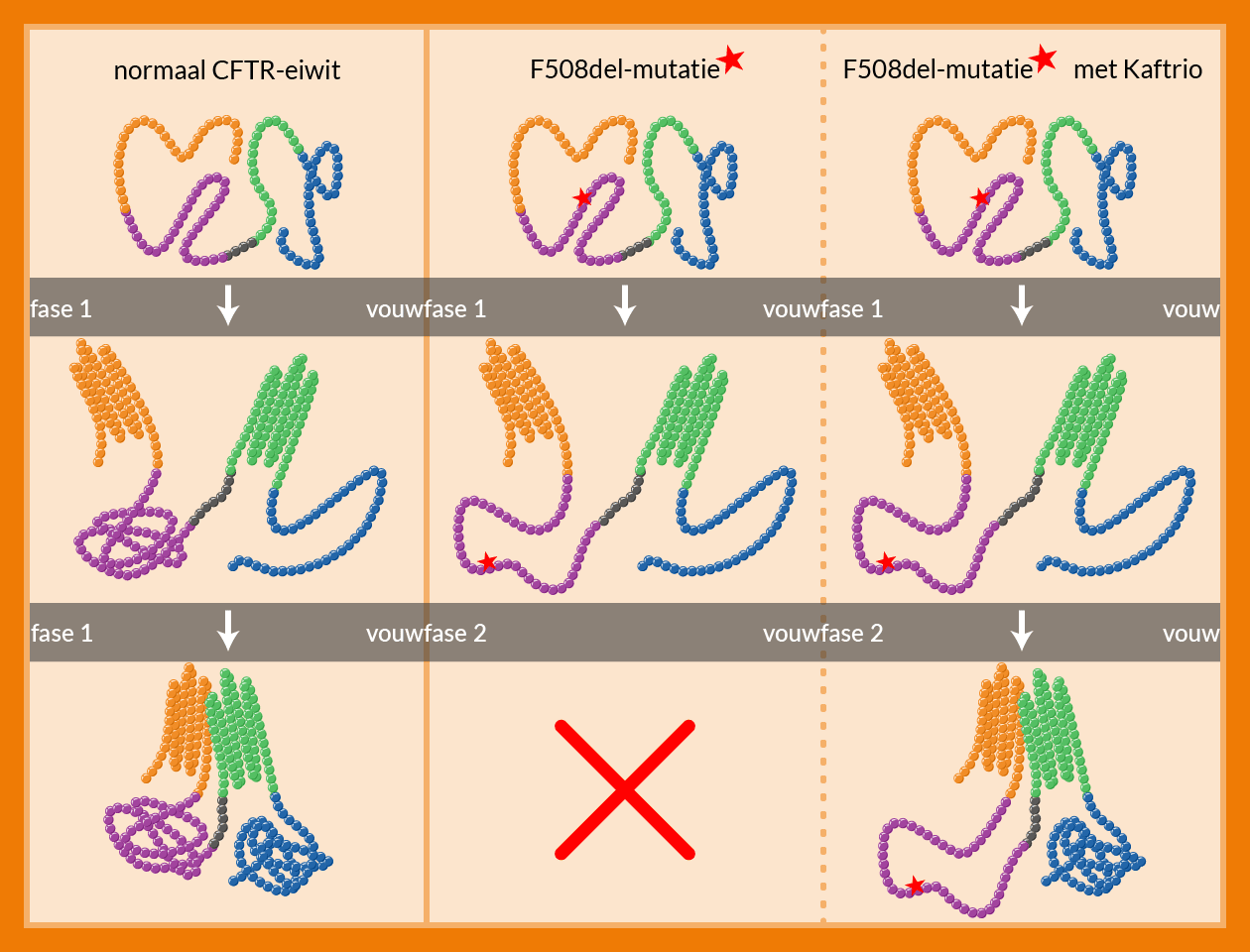
Figuur 1, Vouwing van het CFTR-eiwit: het eiwit begint als een kralenketting aan bouwsteentjes en bestaat uit vier domeinen. In fase 1 vormen de eerste drie domeinen los van elkaar. In fase 2 komt alles samen. Door de F508del-mutatie vouwt één van de domeinen niet in fase 1, waardoor fase 2 niet door kan gaan. Elexacaftor/tezacaftor/ivacaftor (Kaftrio) zorgt ervoor dat ondanks het niet gevouwen domein alles toch samenkomt, waardoor het chloridekanaal weer (deels) werkt.
Het vervolg
We kennen nu een paar belangrijke stappen in het vouwen van het CFTR-eiwit en kunnen het effect van verschillende mutaties en elexacaftor/tezacaftor/ivacaftor (Kaftrio) in kaart brengen. Op dezelfde manier kan de werking van meer medicijnen doorgrond worden. Ook erfelijke variaties en omgevingsfactoren, die zorgen voor verschillen tussen mensen met CF, zijn te onderzoeken. Hiervoor is ook een HIT CF 3.0 project opgezet, dus er is nog genoeg te doen!
Onderzoek
Altijd op de hoogte zijn van nieuws over onderzoek, medicijnen, acties en evenementen? Schrijf je dan in voor onze nieuwsbrief
Inschrijven »Steun mensen met taaislijmziekte
CF is nog altijd een ziekte die niet te genezen is. Om dit te veranderen, is nog veel onderzoek nodig. Wij zetten ons in voor een langer en beter leven met CF. Geef jij ook om taaislijmziekte?
Doneren »